- Favoriser une détoxification de l'organisme
- Polarisation de courant électrique
- Tarifs
- Informations
- Toxines au quotidien
- La détoxification
- Neutraliser les toxines
- Sources
Favoriser une détoxification de l’organisme ?
Une cure de détoxification vous permet d’éliminer le plus possible de déchets de votre corps. Ceux-ci sont évacués de manière rapide et efficace à travers votre circulation sanguine. Pour ce faire, le corps fait surtout appel à l’appareil lymphatique, au foie et aux reins.
L’objectif de détoxifier son organisme est autant d’améliorer son métabolisme, sa vitalité, sa santé que de perdre du poids. Ce grand « nettoyage » du corps que l’on fait à l’occasion d’une cure détox apporte déjà à court terme une sensation de bien-être général.
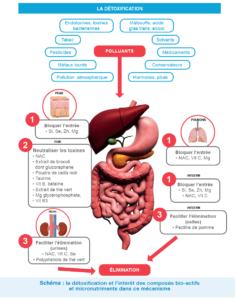
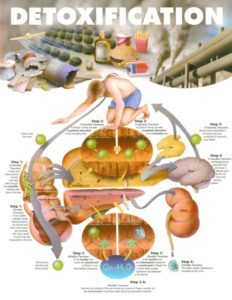
Schéma de détoxification
L’air que nous respirons, l’eau que nous buvons, les aliments que nous consommons contiennent des polluants divers.
On compte aujourd’hui près de 150 000 molécules étrangères à notre organisme dites « xénobiotiques » (ce qui signifie « étrangères à notre biologie »), pour la plupart issues de synthèses chimiques, dans l’air que nous respirons, dans les boissons et l’alimentation, mais aussi dans nos vêtements ou encore dans les divers cosmétiques que nous appliquons sur notre peau.
Une partie de ces molécules proviennent des pollutions engendrées par les industries, l’agriculture intensive, les transports, les produits ménagers…, une autre, de produits que nous consommons (tabac, médicaments, vaccins, alcool mais aussi certains aliments dont les composants sont altérés par des modes de cuisson agressifs (barbecue, friture par exemple).
Lorsque l’on mange trop (ou mal), le corps produit un surplus de déchets qui, ne pouvant être éliminés correctement, endommagent les cellules et impactent notre état de santé général.
Les polluants qui sont solubles dans les graisses peuvent se retrouver piégés par le tissu adipeux. Ils peuvent alors entraîner une réaction inflammatoire.
Le mécanisme de la réaction inflammatoire est un des facteurs qui confère au surpoids sa dangerosité et son installation dans la chronicité.
Exemple le surpoids s’auto-entretient tant qu’on ne casse pas le cercle vicieux lié à la pollution et à l’inflammation.
Technique de “polarisation de courant électrique” pour aider à la détoxification
- Aide à éliminer de l’espace interstitiel les additifs non naturels dans notre alimentation, y compris les stéroïdes qui imitent les hormones et s’attachent aux protéines
- Facilite le drainage lymphatique – Des mouvements rapides de déchets dans les cellules peuvent se produire, ce qui augmente considérablement la livraison de déchets aux organes responsables de l’élimination des déchets corporels.
- Aide à donner vie aux voies lymphatiques stagnantes, créant une barrière immunologique à la maladie
La détoxication lymphatique améliore les processus de guérison du corps en rétablissant la circulation lymphatique dans tout le corps. Les machines d ondes aident le système lymphatique à fonctionner correctement, créant un milieu moins toxique et aidant à résoudre de nombreux problèmes associés au manque de santé à long terme.
Grâce à une technologie de mise en miroir, les photons se couplent pour correspondre à un événement quantique, une enveloppe générée à partir de l’énergie produite par les ondes scalaires.
Cette enveloppe quantique agit comme un support pour les photons couplés, leur permettant de parcourir un trajet omnidirectionnel couplé au corps. Les données de fréquence et l’énergie sont ensuite acheminées dans le champ électromagnétique du corps.
Tarifs :
Sur devis selon les causes pathologiques et méthodes employés : (Ondes scalaires, système Rife&Clark, polarisation courant électrique par bain des pieds, Lens, cef …)
Informations :
Par exemple en 2013, 92% des points de surveillance de la qualité de l’eau fluviale faisaient état de la présence de pesticides, soit la quasi-totalité des cours d’eau en France(1).
http://www.developpement–durable.gouv.fr/IMG/pdf/CS697.pdf
De même, la consommation de produits provenant de l’industrie agro-alimentaire, nous confronte à de nombreux polluants comme le bisphénol A ou les phtalates issus des emballages alimentaires(2-7). La quantité d’aluminium ingérée, provenant surtout d’additifs alimentaires, est évaluée aux USA entre 7 et 9 mg/j en moyenne(8).
Une autre partie provient de notre propre consommation : tabac, médicaments, mais aussi aliments dont les composants sont altérés par des modes de cuisson agressifs(9).
Une femme est amenée dans sa vie à placer environ 11400 tampons hygiéniques dans son vagin. Or, blanchis au chlore ils contiennent des résidus de dioxine incriminés dans de multiples problèmes(10).
Certains de ces polluants, solubles dans les graisses, sont capables de se concentrer dans les viandes et les poissons, mais aussi d’être stockés dans la masse grasse de notre corps : tissu adipeux sous la peau et dans la plupart de nos organes, en particulier le foie et le cerveau, très riches en graisse. Ce phénomène explique à la fois leur neurotoxicité et le fait que lors d’un stress ou d’un amaigrissement, la lipolyse entraîne un relargage de ces toxines liposolubles.
Toxines au quotidien :
Une exposition continue aux toxines alimentaires et environnementales peut dépasser la capacité du corps à métaboliser et éliminer les composés toxiques. Cela peut conduire à l’intoxication qui se manifeste par des signes cliniques visibles : insomnie, migraine, myalgie, et dépression (résistance aux phantidépresseurs)…
Une exposition prolongée aux toxiques présents dans notre environnement peut avoir de multiple conséquences et participer au développement de nombreuses pathologies.
Les auteurs d’une étude sur la toxicité des pesticides ont trouvé des preuves convaincantes d’une association entre l’exposition aux pesticides et des atteintes neurologiques, du génome et de la reproduction : malformations congénitales, mort fœtale, anomalies de croissance…(11).
Le glyphosate ou Round’up, le désherbant le plus utilisé dans le monde, est toxique pour le placenta et il s’agit d’un facteur d’avortements spontanés tardifs(12).
L’exposition à des pesticides est associée à une augmentation des leucémies, des lymphomes non Hodgkiniens, des cancers du cerveau, du sein et de la prostate(13).
Les pesticides sont également responsables d’atteinte dermatologique. On observe notamment un taux plus élevé de dermatites chez les patients fortement exposés aux pesticides en milieu professionnel(11).
Substances chimiques environnementales et risque carcinogène :
Plus de 400 substances retrouvées dans l’environnement sont déjà classées comme cancérigènes sûres ou probables. Certaines pourraient être mises en cause dans au moins 8 types de cancers : du sein, du poumon, de la thyroïde, du testicule, les hémopathies malignes, le mésothéliome, les tumeurs cérébrales et les cancers de l’enfant(14).
Une revue réalisée sur 17 études de cas-témoins et une cohorte a révélé que l’utilisation par le père ou la mère de pesticides ménagers pendant la grossesse, ou la période d’allaitement multiplie de 3 à 9 le risque de cancer chez l’enfant(15).
De plus, les effets de plusieurs toxiques associés peuvent être amplifiés (co-carcinogènes). Les toxiques à effets hormonaux et pro-inflammatoires jouent des rôles promoteurs dans le développement des tumeurs(16).
Perturbateurs endocriniens :
Au cours des dernières années de nombreuses substances ont été identifiées comme étant capables d’interagir avec le système hormonal, elles sont qualifiées de perturbateurs endocriniens. Ces substances interagissent avec la synthèse, la dégradation, le transport et le mode d’action des hormones.
Il existe une grande diversité de perturbateurs endocriniens et les sources de contaminations peuvent être nombreuses, dans l’alimentation via les pesticides, les emballages alimentaires, mais aussi les produits cosmétiques.
Le bisphénol A, provenant des biberons, des emballages plastiques alimentaires, des bouteilles d’eau, des films couvrant l’intérieur des boites de conserves…a des effets oestrogènes-like(17). Une exposition prénatale à cette substance est associée à des anomalies comportementales chez la jeune fille(18).
Notre organisme stocke ce polluant. Chez 1469 adultes, les taux urinaires de bisphénol A ne déclinent pas lors d’une période de jeûne ce qui indique que les sources principales ne sont pas alimentaires et qu’il y a un relargage du tissu adipeux(19).
Les parabènes sont des conservateurs présents dans plus de 80% des produits cosmétiques mais aussi des médicaments et aliments. Des études récentes montrent qu’ils sont capables d’établir des liaisons avec les récepteurs aux œstrogènes. Cette caractéristique conduit à deux risques : une baisse de la fertilité pour l’homme et une promotion de tumeurs œstrogéno-dépendantes(20).
Nous sommes soumis à ce type de polluant tout au long de notre vie et ce, dès le plus jeune âge. Une analyse de la présence de substances toxiques dans les cheveux d’enfants a révélé la présence de 21,52 résidus de pesticides Perturbateurs Endocriniens (PE) en moyenne par enfant. 35 pesticides PE ou métabolites de pesticides PE sur 53 ont été retrouvés au moins une fois, soit 66.03%(21).
Certaines substances comme les polybromodiphényles éthers (PBDE) et d’autres composants persistants organohalogénés utilisés comme retardateurs de flamme sur les matelas, tissus, canapés, mais aussi les vêtements… modifient l’âge de survenue de la puberté chez les filles(22).
Une étude réalisée sur 155 hommes a révélé que la quantité de résidus de pesticides ingérés via les fruits et légumes consommés est corrélée négativement avec la qualité du sperme. Les patients ingérant la plus forte quantité de résidus de pesticides présentent une réduction de leur nombre de spermatozoïdes de 49%, ainsi qu’un pourcentage de formes normales de spermatozoïdes inférieur de 32%(23).
Des métaux toxiques :
Le mercure, le plomb, le cadmium, l’aluminium, l’arsenic, certains sels de chrome et de nickel, le palladium, l’antimoine, le cuivre et le fer en excès retrouvés dans l’air, l’eau, les aliments, certains médicaments et vaccins, les vêtements, mais aussi les peintures ont des effets délétères multiples(24).
Les métaux lourds sont de plus en plus incriminés dans les maladies dégénératives(25).
Dans une étude menée chez 270 élèves d’écoles primaires, une exposition au plomb est associée à des scores neurocomportementaux détériorés. Onze ans plus tard le sous-groupe des 132 enfants les moins exposés est réétudié. Ceux qui ont un taux de plomb dans la dentine supérieur à 20 ppm ont 7,4 fois plus de chances d’abandonner les études et 5,8 fois plus de difficultés à la lecture(26).
Une exposition relativement faible au mercure qui peut concerner de 15 à 30% des populations entraîne une augmentation de l’hypertension, des risques cardiovasculaires, des altérations cognitives, des maladies neurologiques et des altérations du développement in utero(27).
Une exposition au cadmium, dont les sources principales sont le tabac et les aliments, est pro-oxydante, immunodéprimante, néphrotoxique, ostéotoxique et carninogène(28).
Dans une population de 13958 américains, on constate des augmentations de 28% pour la mortalité globale, de 55% pour la mortalité par cancers et de 36% pour la mortalité par infarctus chez les hommes présentant un doublement du taux de cadmium rapporté à la créatinine(29). L’aluminium prend la place du calcium dans l’os, il se précipite sous forme d’alumino-silicates dans les tissus, en particulier dans le cerveau où il est caractéristique de la maladie d’Alzheimer(30). L’aluminium est fréquemment rencontré dans des pansements gastriques, des aliments, de l’eau du robinet, il est pro-oxydant et neurotoxique.
Des toxiques rencontrés dans des lieux ou conditions spécifiques :
Dans l’air :
Pollution de l’air atmosphérique :
Les polluants atmosphériques sont nombreux, parmi eux des gaz (oxydes d’azote, dioxyde de carbone, dioxyde de soufre, ammoniac, ozone…), des composés organiques volatils (COV), des particules en suspension, mais aussi des polluants organiques persistants (POP) : pesticide, dioxine, hydrocarbures aromatiques polycycliques et perturbateurs hormonaux. Ils contribuent à de nombreuses pathologies respiratoires, en particulier l’asthme et sont un facteur de risque de pathologies cardiovasculaires et de cancers. Ils passent dans la circulation et ont des retentissements sur l’immunité, le fonctionnement cognitif et la fertilité.
L’exposition aigüe ou chronique à l’ozone dans l’air pollué des villes entraîne un stress oxydatif, pro-inflammatoire, qui réduit à long terme la fonction respiratoire et contribue aux pathologies respiratoires, dont le cancer du poumon(31). Les dernières estimations de l’OMS montrent qu’en 2012, ce sont 3,7 millions de décès qui ont été provoqués par la pollution de l’air extérieur au niveau mondial(32). Certaines populations plus sensibles car âgées ou porteuses de maladies sont plus touchées(33).
La densité des particules fines PM2,5 par mètre cube d’air a considérablement augmentée au cours des dernières années. Elles proviennent essentiellement du trafic automobile, du chauffage et des activités industrielles. Des chercheurs estiment que 10% des cancers du poumon dans les agglomérations françaises de Paris, Grenoble, Rouen et Strasbourg sont attribuables aux particules de diamètre inférieur à 2,5µm(14).
Les polluants retrouvés dans l’atmosphère ont un effet vasoconstricteur(34). Une augmentation de la densité des particules fines de 10µg/m3 d’air augmente le risque d’accident cardiovasculaire de 24% et la mortalité cardiovasculaire de 76% chez les femmes dans une étude américaine(35).
Tous les 10µg/m3 de polluants atmosphériques en plus, la mortalité cardiopulmonaire augmente de 0,3%(36-37).
Pollution de l’air intérieur :
D’après un rapport de l’institut de veille sanitaire de 2010, nous passons en moyenne 60 à 70% de notre temps quotidien à l’intérieur de notre logement(38).
Ainsi, la qualité de l’air intérieur joue un rôle prépondérant dans l’exposition aux toxiques au cours de notre vie. Le formaldéhyde relargué dans les maisons et les voitures par les contreplaqués, colles de moquettes, matériaux et tissus synthétiques, entraine des conjonctivites et des urticaires. Il est un facteur des cancers du nasopharynx et il est fortement suspecté dans l’incidence des leucémies(39).
Les solvants présents dans des produits de nettoyage, les peintures, les vernis, les encres, certains pesticides, les éthers de glycol sont des causes de fausses couches, malformations, diminution de la fertilité masculine, hématotoxicité(40).
Pollution des eaux et des aliments :
Les polluants retrouvés dans les eaux : nitrates, pesticides, traces de médicaments, métaux lourds, chlore utilisé comme antiseptique, ont des effets directs via la consommation en boisson, mais aussi par bioaccumulation dans les poissons et fruits de mer. Ils ont des effets immunodéprimants, pro-oxydants, génotoxiques, reprotoxiques et cancérigènes(41).
Les dérivés des nitrates trouvés dans l’eau et les nitrites ajoutés dans de nombreux produits, en particulier les charcuteries, forment des nitrosamines, cancérigènes sur l’estomac.
Les nitrosamines augmentent aussi les effets négatifs des graisses sur le diabète, la stéatose hépatique et les phénomènes neurodégénératifs.
Dans les dérivés de cuisson :
Les molécules déformées par la cuisson perdent leurs qualités nutritionnelles et peuvent devenir antigéniques, mutagènes et carcinogènes(42).
Les dérivés mutagènes issus de la déformation des molécules des viandes et poissons à haute température augmentent les risques de cancers du colon, du rectum, du pancréas, du sein et de la prostate(43).
Les hydrocarbures amines polycycliques émis avec les produits grillés ou cuits au feu de bois augmentent les cancers de la prostate, comme le montre une étude menée chez 1226 hommes porteurs de cancer de la prostate et 1127 cas contrôles(44).
Une découverte récente montre que la consommation de viande cuite augmente aussi la fréquence des cancers du poumon(45).
L’acroléine obtenue par la combustion des graisses, en particulier lors des barbecues est mutagène, cancérigène, impliquée dans les pathologies inflammatoires respiratoires et cardiovasculaires ainsi que la maladie d’Alzheimer(46).
Processus de défense contre ces agressions : la détoxification :
Bien évidemment la première chose à faire est de réduire son exposition à tous les toxiques évitables : tabac actif et passif, aliments trop cuits, désodorisants chimiques, médicaments non indispensables, d’assurer des ventilations efficaces dans tous les milieux de travail et de vie et de faire des choix écologiques quant aux cosmétiques, vêtements, aliments, produits ménagers… Malgré tout, les toxiques peuvent s’accumuler dans l’organisme.
La détoxification est un processus qui implique de multiple réactions et fait intervenir 5 organes présentant chacun des fonctions de protection ou d’élimination : le foie, le rein, l’intestin, le poumon et la peau. Ces émonctoires peuvent être stimulés par certaines molécules et leur efficacité dépend de l’énergie disponible dans notre organisme.
En cas de fatigue, ils ne peuvent pas fonctionner de manière optimale. Une supplémentation en magnésium liposoluble associé à son rétenteur cellulaire la taurine permet de diminuer l’état de fatigue général. La vitamine B3 joue aussi un rôle important dans la production d’énergie cellulaire.
Ces organes luttent contre les agressions par 3 grands mécanismes : le blocage de l’entrée, la neutralisation et l’élimination.
Exemple : Bloquer l’entrée des molécules toxiques
Notre corps se défend par des frontières : la peau et les muqueuses bronchique et digestive. Leurs intégrité est assurée par une bonne nutrition, en particulier en acide gras (apports optimisés en acides gras mono-insaturés comme l’huile d’olive et en acide gras oméga 3 : huile de colza et de poisson gras), en antioxydants comme la vitamine C ou la N-acétylcystéine, en probiotiques et en certains minéraux comme le magnésium, le zinc, le sélénium, le silicium et le calcium
Verifier les carences et excès en faisant un bilan avec un Thérapeute de santé avant de prendre ces éléments.
Ces nutriments contribuent à bloquer le passage des substances toxiques à l’intérieur de l’organisme. De plus, les déficits en magnésium, calcium, zinc, sélénium et fer augmentent la toxicité de certains métaux lourds comme le plomb, mercure, cadmium et aluminium(47).
Au niveau de la peau :
La peau constitue la première barrière physique du corps. Certains polluants peuvent tout de même la traverser et passer dans le sang où ils pourront ensuite être stockés dans le tissu adipeux, le foie ou le cerveau.
Certains minéraux comme le magnésium, le zinc, le sélénium, le silicium contribuent à bloquer le passage des polluants dans le sang.
Au niveau de la muqueuse digestive :
Le tractus gastro-intestinal représente une voie d’entrée majeure dans l’organisme pour la plupart des xénobiotiques (25 tonnes de nourriture passent par la voie digestive tout au long de notre vie). L’exposition digestive au chlore (eau du robinet) réduit les taux de glutathion et de vitamine C. L’équipe Bordelaise du Pr Dartigues montre que la consommation d’une eau contenant plus de 0.1mg/l d’aluminium double le risque d’Alzheimer alors que la présence de plus de 11,25mg/l de silicium réduit le risque de 26%(52).
Si la barrière intestinale est altérée, le foie subit un surcroit de travail par la pénétration plus importante de toxines.
La flore intestinale joue un rôle important de barrière et peut activer les voies de détoxification. En cas de défaillance du microbiote, les bactéries pathogènes peuvent augmenter la charge toxique de l’organisme en produisant elles-mêmes des toxines.
Un déséquilibre de la flore du colon provoque également une inflammation qui favorise le passage de molécules indésirables du tube digestif vers le sang.
Ainsi une nutrition de qualité, apportant des probiotiques, des antioxydants, des acides gras essentiels, des vitamines et minéraux permet de renforcer la barrière digestive.
Neutraliser les toxines :
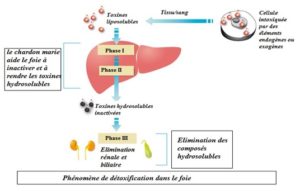
Les substances qui ont franchi les frontières et qui ne peuvent être éliminées directement via les urines ou les selles, peuvent être neutralisées dans les cellules et le sang ou majoritairement en passant par le foie. Cet organe est l’usine de détoxification du corps.
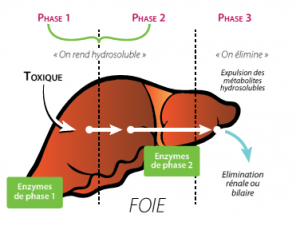
La neutralisation des toxiques dans le foie se fait via 2 phases :
La phase I : elle permet de neutraliser directement certains composés ou elle produit des métabolites intermédiaires. Il s’agit souvent de réactions d’oxydo-réduction.
La phase II : elle permet de modifier la solubilité de ces produits ou de leurs métabolites. II s’agit d’une phase de conjugaison.
Dans les cellules et le sang : Le glutathion : molécule clé des processus de détoxification
Faciliter l’élimination : Les toxiques peuvent être éliminés soit par les urines lorsqu’ils sont hydrosolubles via l’activité rénale soit dans les selles lorsqu’ils sont hydrophobes via l’intestin par les selles.
Dans les urines : Le rein permet l’élimination finale dans les urines des toxines neutralisées lors de la détoxification hépatique.
Dans les selles : En favorisant l’élimination par les selles, on limite les entrées de toxiques par la muqueuse digestive.
Autres voies d’élimination : La respiration complète, la pratique sportive et les séances de sauna favorisent aussi l’élimination des toxiques par l’expiration et la transpiration et la peau et d autres facteurs possibles.
Sources
(1) http://www.developpement–durable.gouv.fr/IMG/pdf/CS697.pdf
(2) Calafat AM, Kuklenyik Z, Reidy JA. et al. Urinary concentrations of bisphenol A and 4-nonylphenol in a human reference population. Environ Health Perspect 2005 ; 113 : 391-5
(3) Factsheet : les phtalates, Office federal de la santé publique OFSP – Unité de direction Protection des consommateurs, 2006
(4) Statement on summary report on acrylamide in food of the 64th meeting of the joint FAO/WHO expert committee on food additives by the Scientific Panel on contaminants in the food chain (CONTAM), EFSA Adopted: 19 April 2005
(5) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, Diamagnetic Susceptibility Exaltation in Hydrocarbons, Journal of the American Chemical Society, avril 1969, vol. 91(8), p.1991-1998
(6) Rapport au Sénat, Risques chimiques au quotidien : éthers de glycol et polluants de l’air intérieur. Quelle expertise pour notre santé ? Conclusions du rapporteur (tome 1) http://senatrice.fr/rap/r07-176-1/r07-176-135.html
(7) Phillipe GUERRIER et al., Guide de gestion du mercure pour les établissements de santé au Québec, Comité de santé environnementale du Québec, 1997.
(8) Pennington JA et Schoen SA, Estimates of dietary exposure to aluminium, Food Addit Contam. 1995 Jan-Feb; 12(1):119-28
(9) Kristin A. Miller, David S. Siscovick, Lianne Sheppard, Kristen Shepherd, Jeffrey H. Sullivan, Garnet L. Anderson, Joel D. Kaufman, Long-term exposure to air pollution and incidence of cardiovascular events in women , New Engl J med, 2007; 356:447-45
(10) UN RAPPORT AMÉRICAIN DÉNONCE LA TOXICITÉ DES TAMPONS HYGIÉNIQUES, BOULAY A., 1995, publié en ligne : http://www.liberation. fr/vous/0101132587-un-rapport-americain-denonce-la-toxicité-des-tampons-hygiéniques
(11) Forson D. and Storfer A., Effects of atrazine and iridovirus infection on survival and life-history traits of the long toed salamander (Ambystoma macrodactylum), Environ Toxicol Chem, 2006, 25(1) pp168-73
(12) Sanborn M, Kerr KJ, Sanin LH, Cole DC, Bassil KL, Vakil C., Non-cancer health effects of pesticides: systematic review and implications for family doctors, Can Fam Physician. 2007 Oct; 53(10):1712-20.
(13) Organisation Mondiale de la Santé. Glyphosate. Critères de la qualité sanitaire de l’environnement, Programme international de sécurité des produits chimiques (IPCS), Genève (1994).
(14) Cancers et environnement, Avril 2009, article de l’inserm publié en ligne : http://www.inserm.fr/thematiques/cancer/dossiers/cancers-et-environ- nement
(15) Zahm SH, Ward MH « pesticides and chilhood cancer » Environmental Health Perspectives 1998, 106, 3 : 893-907
(16) U.S. Interagency Staff Group on Carcinogens, Chemical carcinogens: a review of the science and its associated principles, Environ Health Pers- pect. 1986 Aug; 67: 201–282.
(17) Richard W. Stahlhut, Wade V. Welshons and Shanna H. Swan, Bisphenol A Data in NHANES Suggest Longer than Expected Half-Life, Substantial Nonfood Exposure, or Both, Environ Health Perspect. 2009 May; 117(5): 784–789.
(18) Braun JM, Yolton K, Dietrich KN, Hornung R, Ye X, Calafat AM, Lanphear BP., Prenatal bisphenol A exposure and early childhood behavior, Environ Health Perspect. 2009 Dec;117(12):1945-52
(19) Hoa H. Le, Emily M. Carlson, Jason P. Chua, and Scott M. Belcher, Bisphenol A is released from polycarbonate drinking bottles and mimics the neurotoxic actions of estrogen in developing cerebellar neurons, Toxicol Lett. 2008 Jan 30; 176(2): 149–156.
(20) Darbre PD, Aljarrah A, Miller WR, Coldham NG, Sauer MJ, Pope GS., Concentrations of parabens in human breast tumours, J Appl Toxicol. 2004 Jan-Feb;24(1):5-13.
(21) Rapport enquêtes EXPPERT 3 EXposition aux Pesticides PERTurbateurs endocriniens, Quelles expositions des enfants aux pesticides perturba- teurs endocriniens ? 3ème volet de l’enquête de Générations Futures sur les perturbateurs endocriniens, Avril 2014
(22) Windham GC1, Pinney SM, Voss RW, Sjödin A, Biro FM, Greenspan LC, Stewart S, Hiatt RA, Kushi LH, Brominated Flame Retardants and Other Persistent Organohalogenated Compounds in Relation to Timing of Puberty in a Longitudinal Study of Girls, Environ Health Perspect. 2015 Oct;123(10):1046-52
(23) Chiu YH, Afeiche MC, Gaskins AJ, Williams PL, Petrozza JC, Tanrikut C, Hauser R, Chavarro JE., Fruit and vegetable intake and their pesticide residues in relation to semen quality among men from a fertility clinic, Hum Reprod. 2015 Jun;30(6):1342-51
(24) Navas-Acien A., Silbergeld EK., Sharrett R., Calderon-Aranda E., Selvin E., and Guallar E, Metals in Urine and Peripheral Arterial Disease, Environ Health Perspect. 2005 Feb; 113(2): 164–169.
(25) Staessen JA1, Kuznetsova T, Roels HA, Emelianov D, Fagard R., Exposure to cadmium and conventional and ambulatory blood pressures in a prospective population study. Public Health and Environmental Exposure to Cadmium Study Group, Am J Hypertens. 2000 Feb;13(2):146-56.
(26) Tellez-Plaza M, Navas-Acien A, Crainiceanu CM, Guallar E., Cadmium exposure and hypertension in the 1999-2004 National Health and Nutrition Examination Survey (NHANES). Environ Health Perspect. 2008 Jan;116(1):51-6.
(27) Lustberg M and Silbergeld E., Blood lead levels and mortality, Arch Intern Med. 2002 Nov 25;162(21):2443-9.
(28) Boyd ND, Benediktsson H, Vimy MJ, Hooper DE, Lorscheider FL., Mercury from dental «silver» tooth fillings impairs sheep kidney function, Am J Physiol. 1991 Oct;261(4), 1010-1014.
(29) Barton HA, Cogliano VJ, Flowers L, Valcovic L, Setzer RW, Woodruff TJ., Assessing susceptibility from early-life exposure to carcinogens, Environ Health Perspect. 2005 Sep;113(9):1125-33.
(30) Kumar V., Gill KD., Aluminium neurotoxicity: neurobehavioural and oxidative aspects, Arch Toxicol. 2009 Nov;83(11):965-78.
(31) Chen C., Arjomandi M., Balmes J, Tager I and Holland N., Effects of Chronic and Acute Ozone Exposure on Lipid Peroxidation and Antioxidant Capacity in Healthy Young Adults, Environ Health Perspect. 2007 Dec; 115(12): 1732–1737.
(32) World Health Organization, Burden of disease from Ambient Air Pollution for 2012, summary of results 2014 : http://www.who.int/phe/health_topics/ outdoorair/databases/AAP_BoD_results_March2014.pdf
(33) Air pollution: particularly offensive to the heart. Tiny particles from traffic and industry, along with other pollutants, can trigger heart attacks and spur the development of heart disease, Harv Heart Lett. 2005 Aug;15(12):4-5.
(34) Li Z, Carter JD, Dailey LA, Huang YC, Pollutant particles produce vasoconstriction and enhance MAPK signaling via angiotensin type I receptor, Environ Health Perspect. 2005 Aug;113(8):1009-14.
(35) Air Pollution Tied to Cardiovascular Risks in Women, National Institutes of Health, 2007 february : https://www.nih.gov/news-events/nih-research- matters/air-pollution-tied-cardiovascular-risks-women
(36) Dominici F, McDermott A, Daniels D, Zeger SL, Samet JM.2003. Mortality among residents of 90 cities. In: Revised Analyses of Time-Series Stu- dies of Air pollution and Health. Special report Boston, MA: Health Effects Institute, 9-24.
(37) Les hydrocarbures aromatiques polycycliques, de la recherche à la prévention, Institut national de santé publique Québec novembre 2008 : https:// www.inspq.qc.ca/bise/les-hydrocarbures-aromatiques-polycycliques-de-la-recherche-la-prevention
(38) Zeghnoun A, Dor F. Description du budget espace-temps et estimation de l’exposition de la population française dans son logement. Saint-Maurice (Fra) : Institut de veille sanitaire, octobre 2010, 37 p.
(39) WORLD HEALTH ORGANIZATION INTERNATIONAL AGENCY FOR RESEARCH ON CANCER, Formaldehyde, 2-Butoxyethanol and 1-tert-Bu- toxypropan-2-ol, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 2006; 88: 1-478
(40) Cicolella A, Glycol Ethers: A Ubiquitous Family of Toxic Chemicals, Ann NY Ac Sci, 2006, 1076, 784-789
(41) De la Monte SM, Tong M, Lawton M, Longato L. Nitrosamine exposure exacerbates high fat diet-mediated type 2 diabetes mellitus, non-alcoholic steatohepatitis, and neurodegeneration with cognitive impairment, Mol Neurodegener. 2009 Dec 24;4:54.
(42) Sugimura T., Carcinogenicity of mutagenic heterocyclic amines formed during the cooking process, Mutat Res. 1985 Jun-Jul;150(1-2):33-41.
(43) Zheng W, Lee SA., Well-done meat intake, heterocyclic amine exposure, and cancer risk, Nutr Cancer. 2009;61(4):437-46.
(44) Koutros S1, Berndt SI, Sinha R, Ma X, Chatterjee N, Alavanja MC, Zheng T, Huang WY, Hayes RB, Cross AJ., Xenobiotic metabolizing gene variants, dietary heterocyclic amine intake, and risk of prostate cancer, Cancer Res. 2009 Mar 1;69(5):1877-84
(45) Salnikow K. and Zhitkovich A., Genetic and Epigenetic Mechanisms in Metal Carcinogenesis and Cocarcinogenesis: Nickel, Arsenic and Chro- mium, Chem Res Toxicol. 2008 Jan; 21(1): 28–44.
(46) Menke A., Muntner P., Silbergeld EK. , Platz EA. and Guallar E., Cadmium Levels in Urine and Mortality among U.S. Adults, Environ Health Pers- pect. 2009 Feb; 117(2): 190–196.
(47) The task group on metals interaction, factors influencing metabolism and toxicity of metals, Environ Health Perspect. 1978 Aug; 25: 3–41.
(48) Anne M. Fitzpatrick, W. Gerald Teague, Fernando Holguin, Mary Yeh, and Lou Ann S. Brown, Airway glutathione homeostasis is altered in children with severe asthma: Evidence for oxidant stress, J Allergy Clin Immunol. Author manuscript; available in PMC 2009 Mar 2.
(49) Abe S., Takizawa H, Sugawara I, Kudoh S, Diesel exhaust (DE)-induced cytokine expression in human bronchial epithelial cells: a study with a new cell exposure system to freshly generated DE in vitro, Am J Respir Cell Mol Biol. 2000 Mar;22(3):296-303.
(50) Rahman I., Antioxidant therapeutic advances in COPD, Ther Adv Respir Dis. 2008 Dec;2(6):351-74.
(51) Leustik M, Doran S, Bracher A, Williams S, Squadrito GL, Schoeb TR, Postlethwait E, Matalon S., Mitigation of chlorine-induced lung injury by low-molecular-weight antioxidants, Am J Physiol Lung Cell Mol Physiol. 2008 Nov;295(5):L733-43.
(52) Guiet-Bara A, Bara M., Ethanol effect on the ionic transfer through isolated human amnion. II. Cellular targets of the in vitro acute ethanol action and of the antagonism between magnesium, taurine and ethanol, Cell Mol Biol (Noisy-le-grand). 1993 Nov;39(7):715-22.
(53) Sienra-Monge JJ, Ramirez-Aguilar M, Moreno-Macias H, Reyes-Ruiz NI, Del Río-Navarro BE, Ruiz-Navarro MX, Hatch G, Crissman K, Slade R, Devlin RB, Romieu I., Antioxidant supplementation and nasal inflammatory responses among young asthmatics exposed to high levels of ozone, Clin Exp Immunol. 2004 Nov;138(2):317-22.
(54) Blazka ME, Shaikh ZA., Differences in cadmium and mercury uptakes by hepatocytes: role of calcium channels, Toxicol Appl Pharmacol. 1991 Sep 1;110(2):355-63.
(55) Gillette-Guyonnet S, Andrieu S, Nourhashemi F, de La Guéronnière V, Grandjean H, Vellas B., Cognitive impairment and composition of drinking water in women: findings of the EPIDOS Study, Am J Clin Nutr. 2005 Apr;81(4):897-902.
(56) Goyer RA, Toxic and essential metal interactions, Annu Rev Nutr. 1997;17:37-50.
(57) Goyer RA, Nutrition and metal toxicity, Am J Clin Nutr. 1995 Mar;61(3 Suppl):646S-650S.
(58) Sinha M, Manna P, Sil PC., Induction of necrosis in cadmium-induced hepatic oxidative stress and its prevention by the prophylactic properties of taurine, J Trace Elem Med Biol. 2009;23(4):300-13.
(59) Pastore A, Piemonte F, Locatelli M, Lo Russo A, Gaeta LM, Tozzi G, Federici G., Determination of blood total, reduced, and oxidized glutathione in pediatric subjects, Clin Chem. 2001 Aug;47(8):1467-9.
(60) Dufault R, Schnoll R, Lukiw WJ, Leblanc B, Cornett C, Patrick L, Wallinga D, Gilbert SG, Crider R., Mercury exposure, nutritional deficiencies and metabolic disruptions may affect learning in children, Behav Brain Funct. 2009 Oct 27;5:44
(61) Xu X, Gammon MD, Zeisel SH, Bradshaw PT, Wetmur JG, Teitelbaum SL, Neugut AI, Santella RM, Chen J, High intakes of choline and betaine reduce breast cancer mortality in a population-based study, FASEB J. 2009 Nov;23(11):4022-8
(62) Gebel TW., Arsenic methylation is a process of detoxification through accelerated excretion, Int J Hyg Environ Health. 2002 Oct;205(6):505-8.
(63) Cornblatt BS, Ye L, Dinkova-Kostova AT, Erb M, Fahey JW, Singh NK, Chen MS, Stierer T, Garrett-Mayer E, Argani P, Davidson NE, Talalay P, Kens- ler TW, Visvanathan K., Preclinical and clinical evaluation of sulforaphane for chemoprevention in the breast, Carcinogenesis. 2007 Jul;28(7):1485-90
(64) Riedl MA, Saxon A, Diaz-Sanchez D., Oral sulforaphane increases Phase II antioxidant enzymes in the human upper airway, Clin Immunol. 2009 Mar;130(3):244-51
(65) Brooks JD, Paton VG, Vidanes G., Potent induction of phase 2 enzymes in human prostate cells by sulforaphane. Cancer Epidemiol Biomarkers Prev. 2001 Sep;10(9):949-54.
(66) M. Carmen Ortega-Alfaro, José G. López-Cortés, Hiram Rangel Sánchez, Rubén A. Toscano, Guillermo Penieres Carrillo, and Cecilio Álvarez-To- ledano, Improved approaches in the synthesis of new 2-(1, 3-thiazolidin-2Z-ylidene) acetophenones, Issue in Honor of Prof. Eusebio Juaristi, Arkivoc 2005 (vi) pp 356-365
(67) Fowke JH, Chung FL, Jin F, Qi D, Cai Q, Conaway C, Cheng JR, Shu XO, Gao YT, Zheng W, Urinary isothiocyanate levels, brassica, and human breast cancer, Cancer Res. 2003 Jul 15;63(14):3980-6.
(68) Moon YJ, Wang X, Morris ME, Dietary flavonoids: effects on xenobiotic and carcinogen metabolism, Toxicol In Vitro. 2006 Mar;20(2):187-210.
(69) Amé JC, Spenlehauer C, de Murcia G., The PARP superfamily, Bioessays. 2004 Aug;26(8):882-93.
(70) Dashwood RH, Xu M, Hernaez JF, Hasaniya N, Youn K, Razzuk A., Cancer chemopreventive mechanisms of tea against heterocyclic amine mutagens from cooked meat, Proc Soc Exp Biol Med. 1999 Apr;220(4):239-43.
(71) Pool-Zobel B, Veeriah S, Böhmer FD., Modulation of xenobiotic metabolising enzymes by anticarcinogens — focus on glutathione S-transferases and their role as targets of dietary chemoprevention in colorectal carcinogenesis, Mutat Res. 2005 Dec 11;591(1-2):74-92
(72) Schwartz JL, Baker V, Larios E, Chung FL., Molecular and cellular effects of green tea on oral cells of smokers: a pilot study, Mol Nutr Food Res. 2005 Jan;49(1):43-51.
(73) Kang YJ, Zhou Z., Zinc prevention and treatment of alcoholic liver disease, Mol Aspects Med. 2005 Aug-Oct;26(4-5):391-404.
(74) Forssman S, Frykholm KO., Benzene poising; examination of workers exposed to benzene with reference to the presence of estersulfate, muconic acid, urochrome A and polyphenols in the urine together with vitamin C deficiency; prophylactic measures, Acta Med Scand. 1947 Jun 30;128(3):256- 80.
(75) Du rôle de la pectine dans l’élimination du césium dans l’organisme, résultats d’analyses sur des enfants biélorusses, ACROnique du nucléaire n°67, décembre 2004.
(76) Nesterenko VB, Nesterenko AV, Babenko VI, Yerkovich TV, Babenko IV., Reducing the 137Cs-load in the organism of «Chernobyl» children with apple-pectin, Swiss Med Wkly. 2004 Jan 10;134(1-2):24-7.
(77) Huxtable RJ., Physiological Actions of Taurine, physiological reviews, January 1992, Vol 72, No 1
(78) Tang L, Tang M, Xu L, Luo H, Huang T, Yu J, Zhang L, Gao W, Cox SB, Wang JS, Modulation of aflatoxin biomarkers in human blood and urine by green tea polyphenols intervention, Carcinogenesis. 2008 Feb;29(2):411-7
(79) Chakraborty D, Bhattacharyya A, Majumdar K, Chatterjee K, Chatterjee S, Sen A, Chatterjee GC, Studies on L-ascorbic acid metabolism in rats under chronic toxicity due to organophosphorus insecticides: effects of supplementation of L-ascorbic acid in high doses, J Nutr. 1978 Jun;108(6):973- 80.
(80) Sprince H, Parker CM, Smith GG, Gonzales LJ., Protective action of ascorbic acid and sulfur compounds against acetaldehyde toxicity: implications in alcoholism and smoking, Agents Actions. 1975 May;5(2):164-73.
(81) Zannoni VG, Brodfuehrer JI, Smart RC, Susick RL Jr., Ascorbic acid, alcohol, and environmental chemicals, Ann N Y Acad Sci. 1987;498:364-88.